
喜讯 |达博生物脐带间充质干细胞外泌体获国际INCI备案!
Tue-11-25
目标人群:在饮食和运动基础上,经标准治疗后血糖仍控制不佳的难治型2型糖尿病患者
适应症
2型糖尿病
基本入选标准(部分):
1.年龄18-80周岁。
2.根据1999年WHO糖尿病诊断标准,确诊为2型糖尿病患者,且病程≥10年
3.女性受试者体重≥45kg,男性受试者体重≥50kg,且18.5 kg/m²≤BMI≤28.0 kg/m².
4.筛选时,已根据中国糖尿病防治指南(2024版)的要求,进行饮食和运动控制,使用至少3种口服降糖药或者胰岛素联合至少2种口服降糖药(口服药剂量为标准剂量或者最大耐受量,治疗时长至少3个月),血糖控制不佳(HbA1c≥7.5%)。
5.筛选时,空腹C肽<1.2 nmol/L
6.育龄期女性患者妊娠试验为阴性,同时愿意在研究期间及研究结束后6个月使用可靠的生育控制方法(避孕药除外)。未接受过绝育手术的男性须同意在研究期间及研究结束后6个月采用有效避孕措施。
7.充分了解本试验的目的和要求,愿意在研究期间按照中国糖尿病防治指南(2024版)的要求,进行饮食和运动控制。自愿参加并签署书面知情同意书,能按试验要求完成。
具体关于临床入组标准及申请可点击链接进行查看:https://www.gzdoublle.com/lczm.html

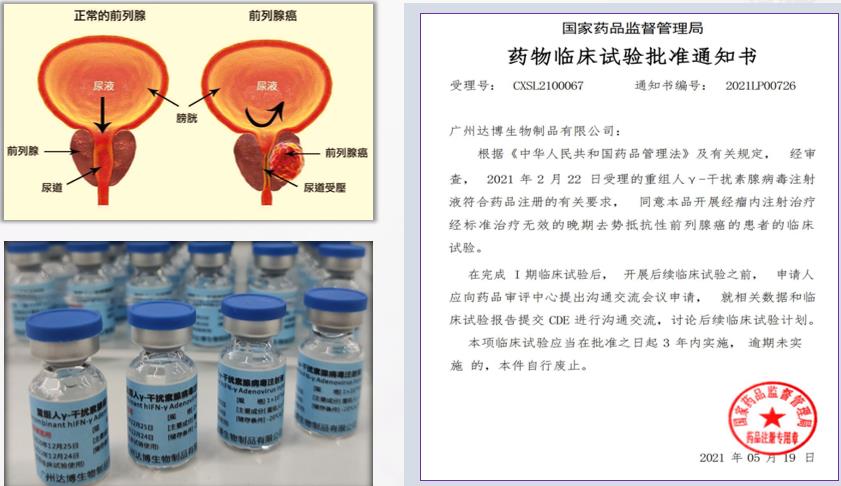
您好!我们正在进行一项名为E10B在晚期去势抵抗性前列腺癌患者中多次给药的安全性、耐受性和初步疗效的的I期临床研究,本试验由广州达博生物制品有限公司申办,已获得浙江大学医学院附属第一医院伦理委员会批准并同意,具体招募信息如下
药物名称/规格:
名称:重组人γ-干扰素腺病毒注射液
规格:1.0*10^12VP/支
适应症
经标准治疗失败的晚期去势抵抗性前列腺癌。
基本入选标准(部分):
18~80岁成年男性患者
经组织学证实的前列腺癌患者
根据病史资料检查结果诊断为去势抵抗性前列腺癌并经标准治疗失败的患者,诊断需 同时具备以下2个条件:
①血清睾酮达到去势水平(<50ng / dl 或<1.7nmol/L);
②生化进展:间隔1周或以上连续3次测量前列腺特异抗原(PSA)上升,连续两次较最低值升高 50%以上,且PSA>2ug/L;或影像学进展:骨扫描发现2个或2个以上的新病灶或符合实体瘤反应评价标准的软组织病灶增大。4)
体力状况:ECOG PS ≤2.5
预计生存期≥3个月
具体关于临床入组标准及申请可点击链接进行查看:https://www.gzdoublle.com/lczm.html
临床入组负责人联系方式:15992025497(微信同号),点击添加微信:https://work.weixin.qq.com/ca/cawcde8faed9657edd
Copyright © 2025 广州达博生物制品有限公司

